.jpg)
“惟楚有才,于斯为盛。”
湖南永州籍 80 后科学家黄晋,他的履历从本科开始,就和湖南大学深深绑定。

图 | 黄晋(来源:黄晋)
本科和直博,均就读于该校化学化工学院,博士则由美国佛罗里达大学和湖南大学联合培养,博士后两年在国家留学基金委资助下,留学美国并获得博士学位。
值得注意的是,做博后研究时,他再次回到湖南大学。从当初化学化工学院的本科生,再到如今成为该学院的教授,20 年时光似乎“眨眼间”流过。
而他也成为了湖南大学岳麓学者、湖南省杰出青年基金获得者以及教育部青年长江学者。
2021 年 12 月 22 日,黄晋团队在 Nucleic Acids Research 上发表了一篇研究论文,题为《光控放大的FRET纳米耀斑:时空可控的、mRNA 驱动的纳米机器用于活细胞内微小RNA的精准、灵敏成像》(Photocaged amplified FRET nanoflares: spatiotemporal controllable of mRNA-powered nanomachines for precise and sensitive microRNA imaging in live cells)[1],论文第一作者为李静博士,黄晋担任通讯作者。
该论文报道了一种时空可控的、细胞内源分子驱动的 DNA 纳米机器,解决了活细胞内低丰度靶标分子“测不到、测不准”难题,实现了精准、灵敏原位检测细胞内低丰度 miRNA 的目标。

图 | 相关论文(来源:Nucleic Acids Research)
针对活细胞内低丰度 miRNA 原位检测,提供“测得到、测得准”新方案
据悉,miRNA 在细胞增殖、分化和凋亡过程中扮演着非常重要的角色,具有类似于致癌基因和抑癌基因的作用。
目前越来越多的数据表明:miRNA 的异常表达与人类疾病密切相关,被认为是诊断和预后的潜在生物标志物。
因此,对于更好地理解其功能、以及疾病相关的调节机理上,可视化定量细胞内 miRNA 具有至关重要的意义。
然而,目前细胞内低丰度 miRNA 原位检测仍然面临一些难题:
其一,miRNA 的部分内在属性欠佳,例如小尺寸、高同源性、低丰度、易降解等;
其二,由于复杂的细胞内环境,生物分子自发荧光探针易被非靶标分子降解或者提早激活,导致检测精准度低比如会出现假阳性;
其三,由于细胞空间尺寸的局限性,细胞内某些 miRNA 的丰度比较低,基于传统的“一对一”信号触发模式即一个靶标触发一个信号,会导致检测灵敏度不足比如会出现假阴性。
针对活细胞内原位检测低丰度 miRNA 的精准度和灵敏度低的难题,黄晋团队开发出上述时空可控的、内源性分子驱动的 DNA 纳米机器,实现了细胞内低丰度 miRNA 的精准、灵敏荧光成像。
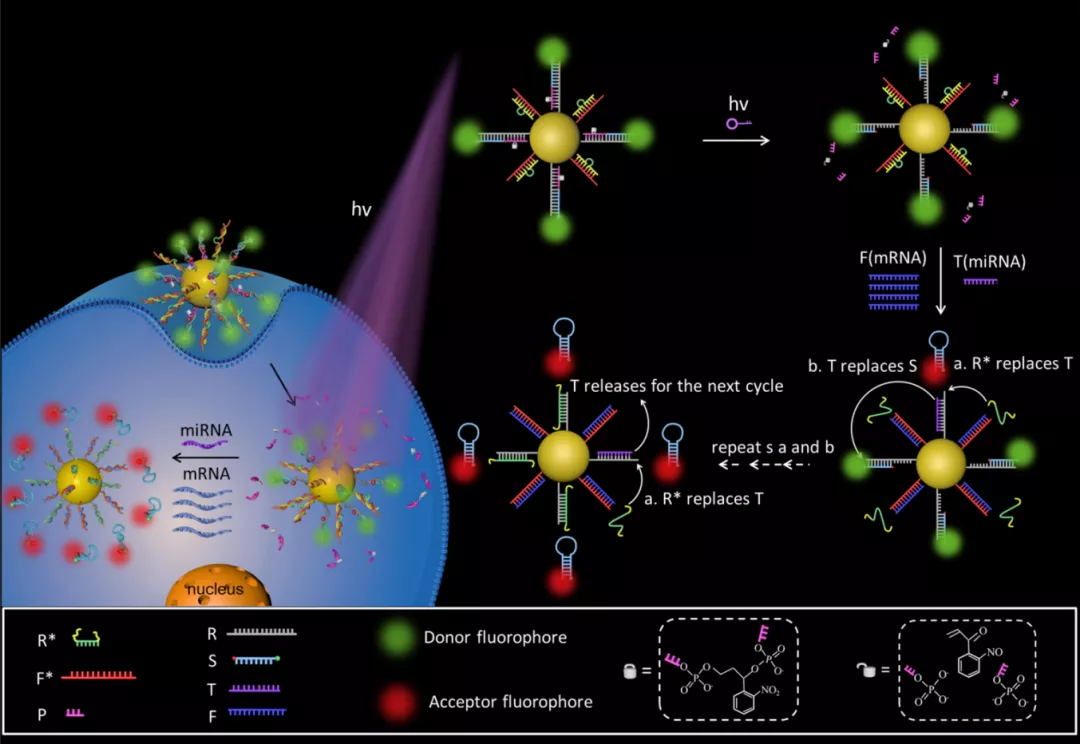
(来源:Nucleic Acids Research)
一方面,他们通过荧光共振能量转移技术(FRET,fluorescence resonance energy transfer)比率型信号输出,有效地避免了系统波动和化学干扰(例如:细胞内谷胱甘肽和 DNA 水解酶)带来的假阳性信号。
同时,让光照作为外界刺激物实时控制探针的初始活性,避免探针在内吞或者运输过程中,即在到达肿瘤位点之前,被提早激活,产生高的非特异性信号,借此提高了检测精准度。
另一方面,其巧妙地利用了内源性、高丰度的 mRNA 分子作为驱动力,实现了“一对多”信号触发模式,即一个靶标触发多个信号,最终实现了活细胞内低丰度 miRNA 的精准、灵敏成像。
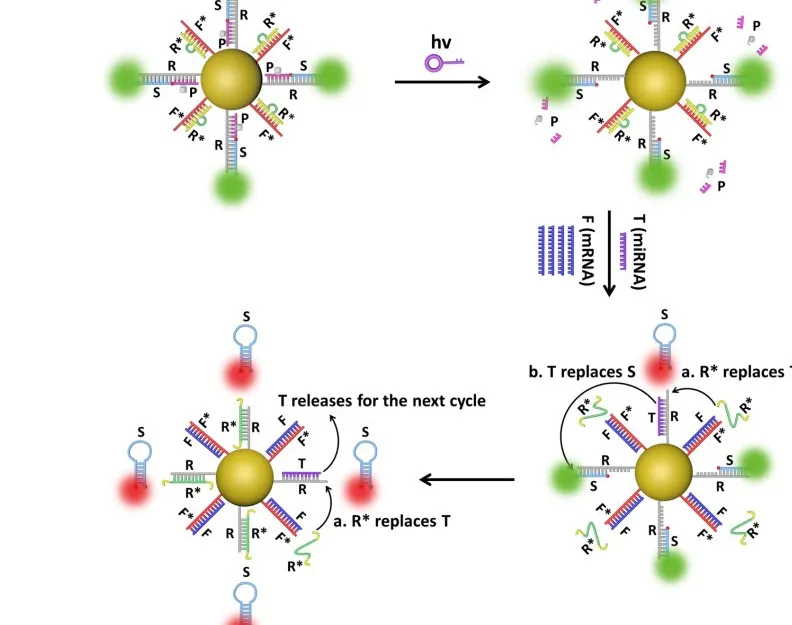
(来源:Nucleic Acids Research)
项目设计理念的源头在 6 年前
冰冻三尺,非一日之寒,此次成果也得益于黄晋多年的积累。
2015 年,该团队曾提出一种新型纳米探针设计概念“FRET纳米耀斑(FRET Nanoflare)”,相比传统的单荧光染料标记的纳米探针,该探针能有效地避免系统波动和化学干扰产生的假阳性信号,提高了检测的精准度[2]。
但是,该 FRET 纳米耀斑的设计仍然是基于“一对一”信号触发模式,即一个靶标只能触发一个信号,对于细胞内低丰度 miRNA 的检测会面临检测灵敏度不足的问题。
因此,设计”一对多“信号触发模式,即一个靶标触发多个信号,是黄晋接下来要极力实现的目标。
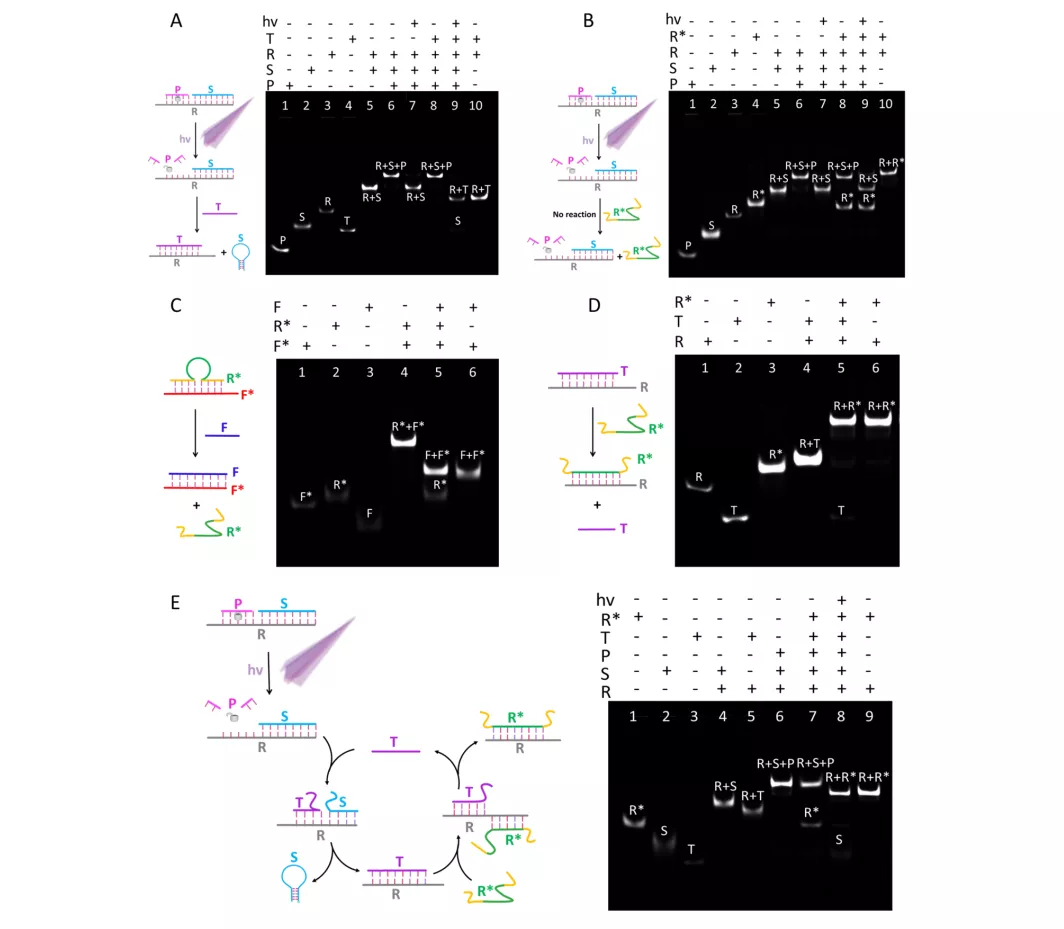
(来源:Nucleic Acids Research)
脱氧核糖核酸酶(DNAzyme),是具有催化功能的单链寡核苷酸,它在特定金属离子的辅助下能循环不断地切割荧光标记的基底链,产生”一对多“信号放大模式,因此被认为是一种有效的信号放大策略。
2016-2017 年,黄晋和团队设计了不同类型的基于 DNAzyme 的纳米机器,其中包括适体酶(Aptazyme)、自切割核酶和裂开核酶,实现了细胞内低丰度分子的灵敏检测[3-5]。
2018 年,基于催化发夹组装(CHA)技术,他们又构建出一种发夹驱动的 DNA 纳米机器,实现了活细胞内 miRNA 的放大成像[6]。
但是,上述设计通常需要外加辅离子、或辅助分子来驱动纳米机器的循环运行,这不仅会导致检测过程复杂化,而且会改变原有的检测体系,进而会降低纳米机器的运行效率。
此后,该团队尝试利用细胞内源性高丰度 mRNA 作为燃料分子驱动纳米机器的运行。通过大量的文献调研和多次细致的讨论,他们巧妙构建了基于内源性、高表达的 mRNA 分子作为驱动力设计的一种放大的 FRET 纳米耀斑。
本质上,FRET 纳米耀斑是一种内源性 mRNA 驱动的 DNA 纳米机器,最终可实现”一对多“信号放大模式,其检测灵敏度相比于”一对一“信号触发模式提高了大约 3 个数量级[7]。
然而,该探针的初始活性是不可控的,探针在到达肿瘤位点之前,一旦遇到靶标就会直接和它们相互作用,使探针被提早激活,产生非特异性信号,导致检测精准度低。
由于光可以在空间和时间上被精准地操控,因此通常被作为一种有效地外界刺激物用于生物正交调节和精准调控生物传感器的活性。
基于此,黄晋采用光照作为外界刺激物实时控制探针的初始活性,使探针在运输或者内吞过程中一直处于失活的状态。
进入细胞以后,通过光照在特定时间和特点地点被选择性地激活。随后,在低丰度 miRNA 的触发下、以及高丰度 mRNA 的驱动下,探针即可自动地、程序性地在活细胞内运行,不需要外加辅助物。
这不仅有效简化了操作过程,还可提高纳米机器的运行效率,进而提高了检测精准度和灵敏度。
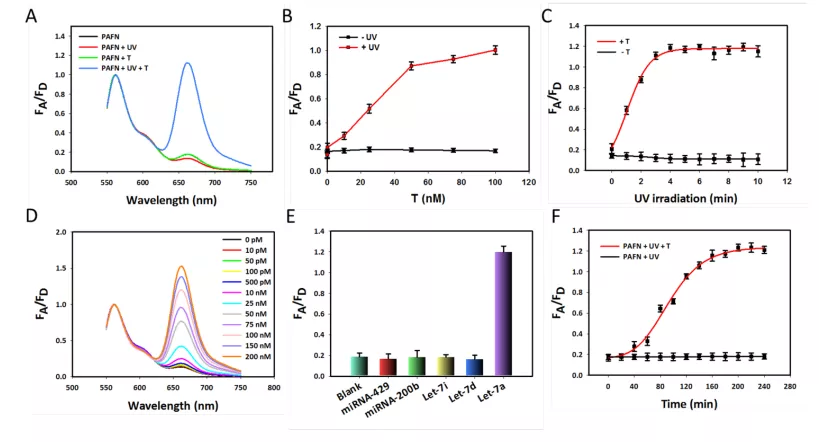
(来源:Nucleic Acids Research)
为活体或细胞层面实现低丰度靶标的原位成像,提供新思路
探针进入肿瘤细胞以后,黄晋通过光照选择地激活探针,随后继续与细胞进行孵育。
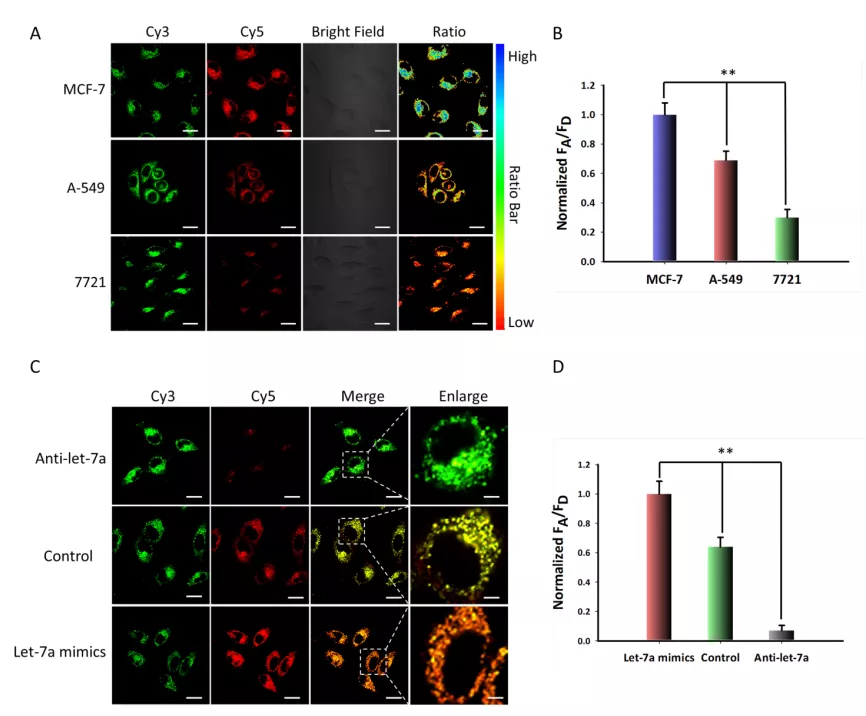
他和团队发现,只有在光照和靶标分子同时存在的条件下,肿瘤细胞内才能产生很强的 FRET 荧光信号。在没有光照的情况下,即使有 miRNA 的存在,细胞内也几乎没有明显的 FRET 信号。
这说明该探针的初始活性是可控激活的,这种现象类似于“两把钥匙开一把锁”,提高了检测的准确度和可信度。
除此之外,为验证其信号放大效果,该团队采用传统的“一对一”信号触发模式的纳米耀斑作为对照,发现其FRET荧光信号明显低于本次实验设计的“一对多”信号触发模式的纳米耀斑,表明“一对多”信号放大模式的检测灵敏度显著提高。
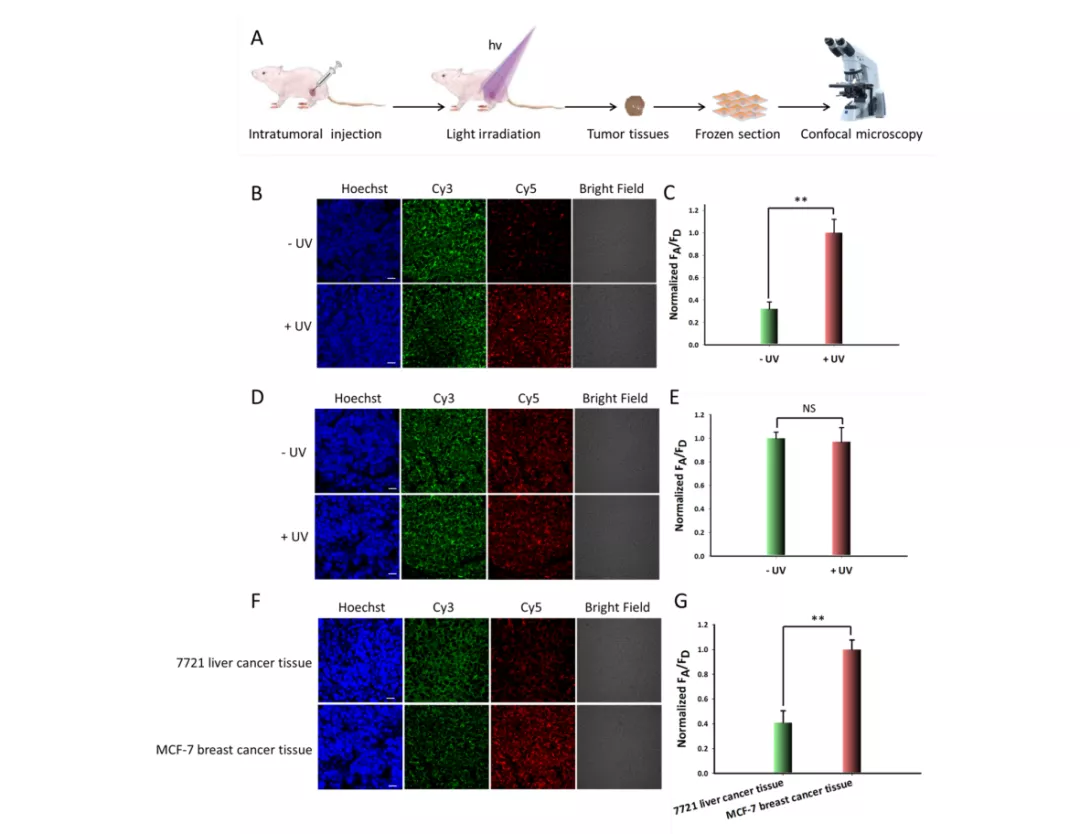
类似地,他们将时空可控的、mRNA 驱动的纳米机器用于动物实验,发现只有在光照和肿瘤组织同时存在的情况下,才能在肿瘤部位产生显著的 FRET 荧光信号。
因此,远程光激活的、放大的 FRET 纳米耀斑能够实现肿瘤组织内 miRNA 的精准、灵敏成像。
概括来说,此次研究理念为活细胞内原位荧光成像低丰度靶标提供了新的研究思路,避免了外加辅助物导致原有检测体系被破。
由于细胞内含有大量的蛋白、核酸和小分子,这为他们设计内源性分子驱动的 DNA 纳米机器用于执行活体内特定的任务提供了前提条件。
(来源:Nucleic Acids Research)
难忘的“柳暗花明、茅塞顿开”
黄晋说,研究中最让人难忘的事,当属该团队每周的组会讨论。在讨论过程中,总会有新的问题不断的被提出、随后通过各种途径不断地寻求解决办法。
问题解决时,那种“柳暗花明、茅塞顿开“的喜悦之情,以及在项目执行过程中大家孜孜不倦的探索精神,都变成了最美好、难忘的时光。
(来源:Nucleic Acids Research)
虽然内源性驱动的概念早有报道,例如小分子 ATP,但是 ATP 与其核酸适配体(aptamer)的相互作用力有限。
如何发展新的内源性驱动力设计“一对多”信号放大模式,是过去一段时间来团队内部经常讨论的话题。
在实验以及投稿过程中,他们经历了一次次失败,一次次重复,沮丧过也迷茫过。
该团队表示:“依然记得在文章来意见后补实验的过程中,经常因为要做共聚焦实验和电泳实验熬夜到很晚,一天实验之后,大家还要一起继续讨论实验结果并制定第二天的实验方案,每个人都乐此不疲。”
对于未来黄晋表示,精准、灵敏可视化定量细胞内低丰度分子,对于基础研究和临床医学,都具有重要研究价值和应用潜力。
(来源:Nucleic Acids Research)
因此在后续研究计划中,一方面可以结合肿瘤治疗药物,实现诊疗一体化设计。另一方面,目前可利用的内源性驱动分子的种类和含量具有一定的局限性,在一定程度上限制了其广泛的应用。
因此,有必要探究新的可利用的内源性物质,例如:内源性离子、小分子和蛋白质等,从而构建出内源性驱动的 DNA 纳米机器执行各种新的任务。
-End-
参考:
1. Photocaged amplified FRET nanoflares: spatiotemporal controllable of mRNA-powered nanomachines for precise and sensitive microRNA imaging in live cells. Nucleic Acids Res.
2. FRET Nanoflares for Intracellular mRNA Detection: Avoiding False Positive Signals and Minimizing Effects of System Fluctuations. J. Am. Chem. Soc. 2015, 137, 8340-8343.
3. Aptazyme−Gold Nanoparticle Sensor for Amplified Molecular Probing in Living Cells. Anal. Chem. 2016, 88, 5981-5987.
4. Gold Nanoparticle based Hairpin-Locked-DNAzyme Probe for Amplified miRNA Imaging in Living Cells. Anal. Chem. 2017, 89, 5850−5856.
5. Gold Nanoparticle Loaded Split-DNAzyme Probe for Amplified miRNA Detection in Living Cells. Anal. Chem. 2017, 89, 8377−8383
6. Hairpin-fuelled catalytic nanobeacons for amplified microRNA imaging in live cells. Chem. Commun., 2018, 54, 10336-10339.
7. Amplified FRET Nanoflares: An Endogenous mRNA-Powered Nanomachine for Intracellular MicroRNA Imaging. Angew. Chem. Int. Ed. 2020, 59, 20104 -20111
