.jpg)
药品概况
药物名称:Vitrakvi(Larotrectinib,拉罗替尼,又名LOXO-101)
美国上市时间:2018年11月26日
批淮单位:美国食品和药物管理局(FDA)
药物功效:有效对抗由单一罕见基因(NTRK)突变驱动的各种癌症
针对人群:患有实体肿瘤的成人和儿童患者
制造企业:Bayer(拜耳)和Loxo Oncology共同研发
全球肿瘤医生网仅为患者提供全球抗癌新药上市及用药最新信息,如需了解详情可致电医学部400-666-7998。
到货时间:预计全球最早到货时间为2019年1月12日左右,以实际到货时间为准!
货品规格:目前可以提供25mg*60粒/每瓶
建议用量:官方建议用法每日口服两次,每次100毫克;建议由低剂量开始服用每日口服两次,每次50毫克。
价格估计:Vitrakvi (larotrectinib)建议售价为20万-21.5万/月。
我们再来回顾一下LOXO-101的传奇上市历程!
2018年11月26日,传奇抗癌药larotrectinib(LOXO-101)终于获得FDA批准,用于治疗患有NTRK基因融合的局部晚期或转移性实体瘤的成人和儿童患者。同时,这款药物也有了自己的大名Vitrakvi!

可以说,从2016年12月18日,Loxo oncology 公司的TRK抑制剂Larotrectinib(LOXO-101)初次在ESMO大会亚洲一期试验中展示对TRK融合肿瘤显示的持久抗肿瘤活性,就震惊了肿瘤界,这款不分癌症种类的广谱抗癌药开启了肿瘤治疗的新篇章,具有划时代的意义。
这一药物的批准,是癌症疗法从“基于癌症在体内的起源”转向“基于肿瘤的遗传特征”这一演变过程中的重要里程碑。
我们来回顾一下这款“神药”从研发到上市的光辉历程:
2016年12月18日Loxo oncology TRK抑制剂Larotrectinib(LOXO-101)在ESMO亚洲第1阶段更新中显示穿越TRK融合癌的持久抗肿瘤活性;
2017年2月21日Loxo Oncology宣布完成Larotrectinib NDA主要疗效分析的临床试验注册;
2017年5月12日FDA宣布授予Larotrectinib孤儿药物称号,指定用于治疗NTRK融合蛋白的实体肿瘤;
2017年6月3日Loxo Oncology突破疗法Larotrectinib在美国临床肿瘤学会提交的TRK融合成人和儿童癌症中显示76%客观反应率!
2017年12月12日Loxo Oncology更新Larotrectinib儿童临床试验数据显示TRK融合的持续耐受性;
2017年12月20日Loxo Oncology开始向美国食品和药物管理局提交Larotrectinib新药申请用于治疗TRK融合肿瘤;
2018年2月21日Loxo Oncology宣布在新英格兰医学杂志上发表Larotrectinib临床数据:权威发布!针对17种肿瘤的传奇抗癌药LOXO-101最新研究数据公布!有效率75%!
其中有一些晚期患者的病灶完全消失了:
我们可以清楚的看到,这位极晚期的肉瘤患者,肿瘤已经快要填满双肺,经过LOXO-101治疗12周期,肿瘤几乎完全消失!
治疗前 治疗3周期第1天 治疗13周期第1天
2018年3月26日Loxo Oncology完成Larotrectinib治疗TRK融合癌新药申请滚动提交;
2018年3月28日在线的权威肿瘤学杂志柳叶刀上公布了传奇抗癌药larotrectinib(LOXO-101)的最新研究数据!该药在部分儿童癌症患者达到了93%的治疗应答!重磅新数据!针对17种肿瘤的传奇抗癌药LOXO-101公布新数据,这次有效率高达93%!
2016年,13岁的的Briana Ayala,被发现在她的腹部有一个罕见的肿瘤,包裹在她的主动脉周围。Briana参加了larotrectinib的1期临床试验,几周之内,她的腹部疼痛和肿胀消失,扫描显示她的肿瘤显着缩小。将近两年后,Briana重返学校!

德克萨斯大学西南分校的研究人员表示,larotrectinib在1期临床试验中93%的儿科患者有效。(照片由比尔布兰森/国家癌症研究所提供)

2018年5月29日FDA接受Larotrectinib新药申请并授予优先审查;
2018年10月21日Larotrectinib在109个TRK融合癌症患者的扩展数据显示81%的总体反应率;权威公布!“治愈系”抗癌明星药LOXO-101新数据:有效率81%!下个月上市(附PDF)
此次批准是基于larotrectinib在多项临床试验中的表现。根据今年10月在欧洲肿瘤内科学会(ESMO)年会上公布的最新数据,在55名可以用RECIST标准衡量的TRK融合癌患者中,larotrectinib能够达到80%的客观缓解率(ORR)。值得注意的是,larotrectinib在多种癌症类型中的表现都非常一致。
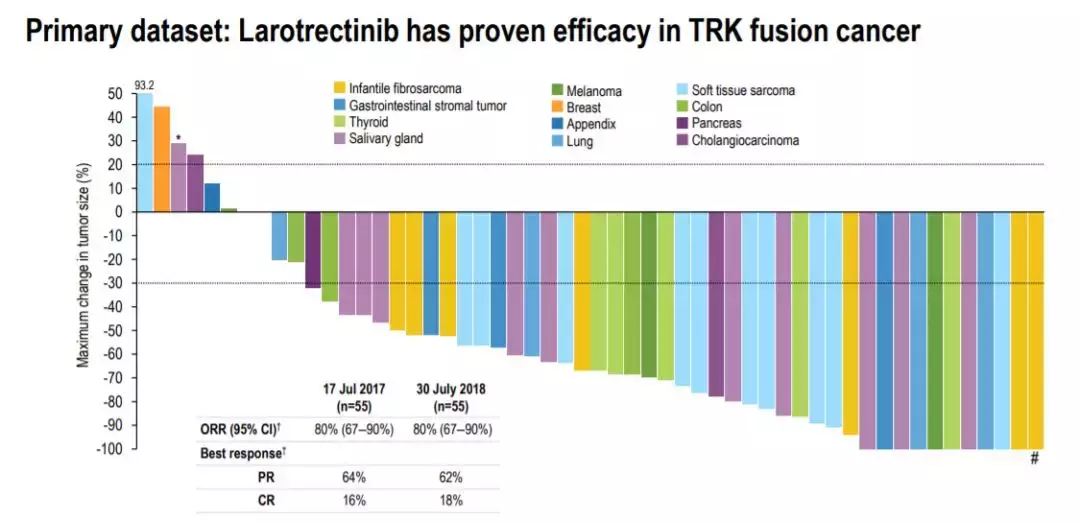
▲Larotrectinib在多种肿瘤类型中都有一致的有效性(图片来源:Loxo Oncology官网)
这是FDA第二次批准基于不同类型肿瘤的常见生物标志物的癌症治疗,而不是肿瘤起源的身体部位。PD-1的获批和TRK抑制剂的成功,为不区分肿瘤来源广谱抗癌药物快速发展奠定了基础,让梦想照进现实!
关于LOXO-101一定要了解!
1
哪些癌症可以使用?
这个靶向药不仅疗效显著,还是广谱抗癌药物,对很多不同肿瘤都有效!这也这个药品这么吸引眼球的原因。
在实验中,这些患者肿瘤类型包括10种不同的软组织肉瘤,唾液腺癌,婴儿纤维肉瘤,甲状腺,肺,黑素瘤,结肠,胃肠道间质瘤(GIST),乳腺癌,骨肉瘤,胆管癌,原发性未知癌,先天性中胚层肾癌,阑尾和胰腺癌。
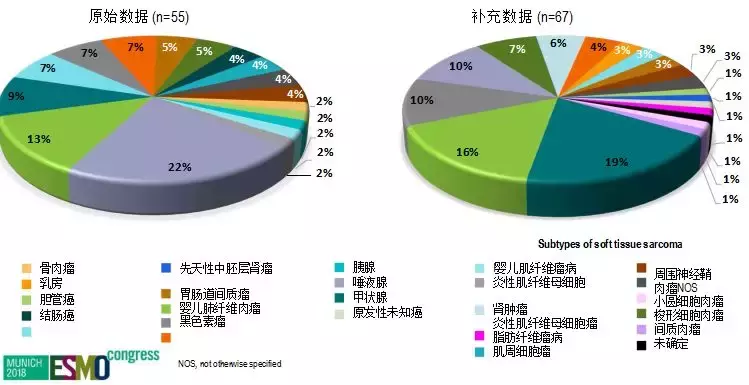
PD1免疫药物被批准用于MSI-H分子类型的各种肿瘤,成为第一个“广谱免疫药物”。LOXO-101很有可能后来者居上,应该会是第一个上市的“广谱靶向药物”。
因此,只要你经过基因检测,存在
NTRK1、NTRK2或者NTRK3基因融合,理论上都是适合的!
重要的事情说三遍:用前基因检测,基因检测,基因检测!!!
全球肿瘤医生网新年抗癌优惠活动,基因检测优惠多多!
链接如下:
跨年钜惠!2019年基因检测及癌症精准治疗回馈活动!
新年大礼包!庆双节权威专家会诊回馈活动!
新年第一天,快来领取专属你的“抗癌指南”!
梦想终将照进现实!
Larotrectinib的批准反映了使用生物标志物指导药物研发和靶向递送药物领域的重大进展。越来越多的医生将有能力让合适的患者在正确的时间获得匹配药物的治疗!
我们处在一个充满奇迹的时代,快速发展科技给人类带来了新的希望。曾经,癌症是不治之症。但随着抗癌手段的不断更新,尤其分子靶向药物等新一代的治疗方法的出现,人类全面战胜癌症的那天不再遥不可及。让我们一起见证这一天的来临!
参考资料:
https://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm626710.htm
https://www.loxooncology.com/docs/presentations/Lassen_Laro_ESMO2018.pdf(PDF下载链接)
https://ir.loxooncology.com/press-releases/2372560-Loxo-oncology-announces-larotrectinib-clinical-update-in-patients-with-trk-fusion-cancers-at-the-european-society-for-medical-oncology-2018-congress
